2020年10月,公司血液研究所李想教授团队在血液学TOP期刊Haematologica (影响因子:7.116)上发表题为 “Elevated TWIST1 expression in myelodysplastic syndromes/acute myeloid leukemia reduces efficacy of hypomethylating therapy with decitabine” 的文章。该研究发现转录因子TWIST1参与调控MDS/AML细胞对地西他滨耐药性方面的分子机制,并揭示以此作为靶点对地西他滨耐药的MDS患者进行治疗的潜在价值。
骨髓增生异常综合征(myelodysplastic syndromes,MDS)是由于全能干细胞水平上的恶性变化导致的分化障碍的血液病,大约30%的高危MDS会发展成急性髓细胞白血病(acute myelocytic leukemia,AML)。近年来,越来越多的研究显示表观遗传学的失调对MDS的发生发展至关重要。因此去甲基化药物地西他滨(5-Aza-deoxycytidine,decitabine,DAC)被广泛用于治疗MDS,并取得了较为显著的临床疗效,但部分患者仍对该药物没有明显应答。目前,MDS中DNA异常甲基化发生的原因,以及对去甲基化药物产生耐药性的分子机制尚不清楚。
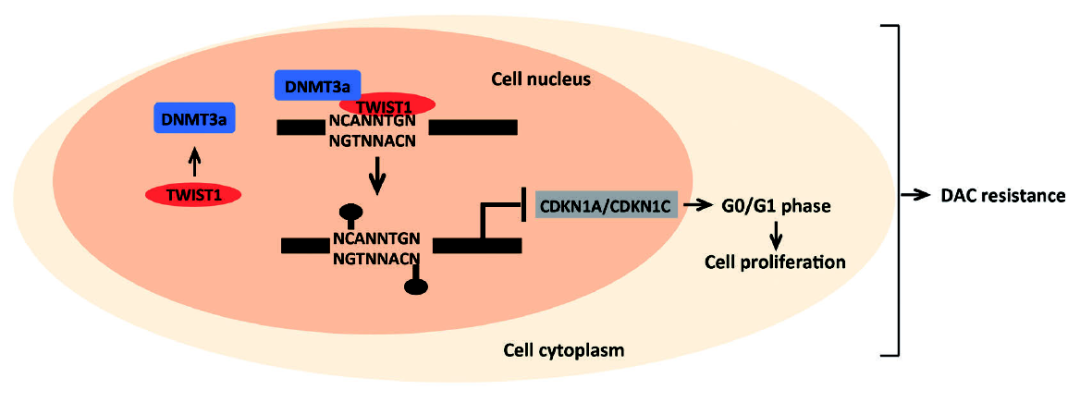
李想教授团队通过分析临床样本,发现地西他滨耐药的MDS/AML病人血液细胞中TWIST1的表达、基因组甲基化水平以及甲基转移酶DNMT3a的表达显著高于地西他滨敏感的MDS/AML病人。 体内和体外实验的功能学实验证明,过表达TWIST1能够增强MDS/AML细胞对地西他滨的耐药,而敲减TWIST1可以增强细胞对地西他滨的敏感程度。 进一步通过液相色谱-质谱联用技术发现TWIST1可以与DNMT3a相互作用,利用多肽阵列芯片鉴定出TWIST1上与DNMT3a互作的关键位点,发现封闭该位点可以有效减弱细胞对地西他滨的耐受性。 通过基因组甲基化芯片发现过表达TWIST1后细胞周期依赖性激酶抑制因子CDKN1A及CDKN1C的启动子区甲基化水平显著升高,影响基因表达,从而影响细胞周期,使细胞产生耐药(图1)。
李鸿姣博士与陕西省人民医院血液科王一主任医师为本文共同第一作者。西北老员工命科学与医学部关锋教授和李想教授为共同通讯作者。该研究受到国家自然科学基金,陕西省自然科学基金和英国威廉希尔唯一官网登峰计划项目资助。
李想教授团队多年来一直致力于MDS疾病发病机理以及骨髓微环境对MDS疾病进程影响的研究,已获得多项国家自然基金项目资助。该研究是继李想教授发现TWIST1促进MDS疾病进程的研究成果后的又一深入探究,将为MDS的临床治疗提供新的思路。